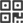今年3月份,哈佛大学Hansörg Wyss生物工程教授Jennifer A. Lewis领导的一个研究团队发明了一种方法,可以用人类干细胞、细胞外基质和内衬血管内皮细胞的循环通道3D打印出厚实的血管化组织构造,并将活性保持了一个多月时间。如今这个团队又更进一步,3D生物打印出了一个管状的3D肾结构,该结构能够再现肾的功能,从而向着生物打印功能性人体组织和器官又迈进了一步。
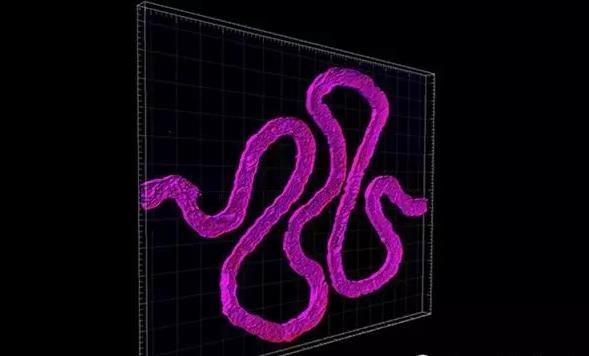
通过与罗氏制药公司的科学家Annie Moisan的密切合作,他们在之前的基础上构建出了一个功能性的3D肾结构,这个结构包含活的人类上皮细胞,该细胞组成了肾小管表面。目前这项研究已经在线发表在了《Scientific Reports》杂志上。
“目前的工作进一步扩展了我们的生物打印平台以打造功能性的人体组织结构,这一工作兼具技术和临床方面的意义。”Lewis教授说。
由Lewis的团队创建的3D肾结构模拟的是近端小管,是肾小管中最长最粗的一段,是每个肾单位的重要组成部分。所谓的肾单位,担负着在血液与尿液之间进行转换的关键功能,人类每侧肾脏都拥有100—150万个肾单位。在肾近端小管的卷曲处,大约65-80%的营养物质会从肾滤液中重新吸收并运回血液。因此,研究团队此次生物打印的3D肾架构重现了整个肾的一个非常小——但是非常关键的——亚单元。
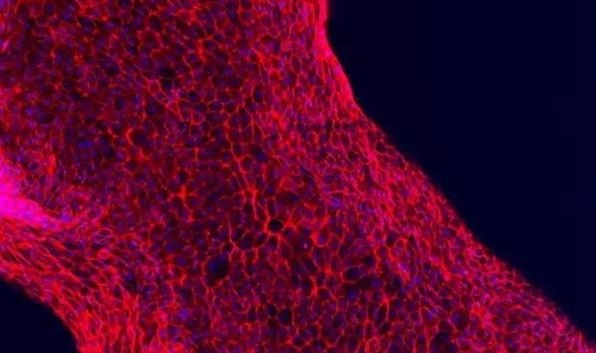
据悉,Lewis的团队是利用他们早先开发的生物打印活细胞以形成厚组织的方法来实现这一成果的,以下是基本步骤:
用一个可自定义的3D打印硅胶垫片作为模具,他们一开始通过“铸造”一个设计好的细胞外基质作为基础层。
然后,一种“逃逸墨水”(它最终会液化并从最后的结构中去除)会被打印成复杂、缠绕的管状,这种形状类似于天然肾近端小管的结构。
打印出来的结构随后被另一层细胞外基质封装起来。

最后,整个结构被冷却,“逃逸墨水(fugitive ink)”也被去除,结果就是一个被嵌入细胞外基质的开放小管。
下一步,在小管两端的入口和出口灌注细胞生长液,然后再灌注人类近端小管细胞,这些细胞会迅速附着在该管道的内壁上。
最终,这些细胞会形成一个紧密堆积的单层,并成为小管内腔和外面的细胞外基质之间的细胞屏障。
在这个过程中养分会通过小管的入口和出口处灌注进来,滋养活细胞并在两个多月的时间里保持它们的活性和功能。
当细胞成熟后,该3D肾结构就开始履行与自然的肾近端小管相同的重要功能。人们可以将药物或其他东西灌入该3D肾结构,以研究其肾毒性及对近端小管细胞的整体影响。
该研究的共同第一作者Kimberly Homan和David Kolesky强调说,这一研究成果最令人兴奋的方面是,它是一种可信的体外模型,而且其功能像活的肾组织,与传统的2D细胞培养相比,这是一个巨大的进步。
研究人员们称,长远来看,他们的方法可以进一步发展为制造植入物或器官辅助装置。而在短期内,它也将为临床医师提供一个能够根据病人具体特点评估治疗方案或进行疾病诊断的强大工具,同时也是一个非常有效的方式来帮助制药公司确定药物对健康和肾功能的影响。
而且,作为一种制造平台,这种方法是灵活、可扩展且适应性强的,也就是说,利用这种方法,研究团队除了努力争取制造出更大的肾脏结构之外,还计划探索其他类型的人体组织和器官。







 大家都在看
大家都在看





 3D打印直通车
3D打印直通车 上传STL文件
上传STL文件 挑选模型
挑选模型