近年来,3D打印医疗器械技术及应用成为业界热议的话题,不少企业亦花费巨资研发新技术与产品。近日,中国食品药品检定研究院(以下简称中检院)官网发布通知,公开征求行业标准《用于增材制造的医用Ti-6Al-4V粉末》意见。项目由国家药品监管局提出,中检院为归口单位,标准起草单位为北京爱康宜诚医疗器材有限公司及中检院等。据悉,医用増材制造Ti-6Al-4V粉末是3D打印钛合金植入物的原料,制定其标准旨在为医用粉末原料供应商、医疗器械制造商和监管部门等提供粉末特性评价和质量控制参考,为相关企业质量管理提供指导,也为监管部门制定相关法规政策提供技术支持。
“3D打印医疗器械产品有节省资源、实现定制化等诸多优点,但相关产品的风险也因而凸显。面对现阶段评价技术缺乏的情况,医疗器械检验所将积极开展医用3D打印技术标准体系建设工作和标准预研工作,持续推动行业进步与发展。”中检院医疗器械检验所所长杨昭鹏表示。
利好:3D打印医疗器械迎利好
2014年,3D打印医疗器械被列为《国家增材制造产业发展推进计划(2014-2016年)》发展重点之一。2015年全国两会期间,全国人大代表、北京大学第三医院骨科主任及脊柱外科研究所所长刘忠军,提出成立加快3D打印医疗科技创新产品审批和应用的建议。
今年2月底,医疗器械技术审评中心公布了《定制式增材制造医疗器械注册技术审查指导原则》(征求意见稿),将国内3D打印医疗器械的临床应用和上市流通提上日程,3D打印与医疗器械行业迎来重大利好。
“3D打印医疗器械的原料是粉末和液体,直接打印出产品,可以节省很多资源。此外,产品能够实现定制化、个性化制造。如每个骨肿瘤患者的肿瘤形状不一样,切除骨组织后,缺损的形状也不一样,用3D打印就可以根据患者的情况去定制。”杨昭鹏指出,通过3D打印出来的产品有着精密的内部结构,有助于病人整体恢复;而传统的铸造方法就很难实现。
该所负责医用增材制造标准制修订工作的副研究员韩倩倩表示,我国非常重视3D打印医疗器械行业的发展。现阶段的3D打印技术,可应用于手术演练模型、个性化骨科植入医疗器械、组织工程支架等产品的制造。其中,组织工程支架打印结合细胞打印为再生医学领域复杂组织器官结构的制造带来希望。近几年,中检院已经在检测工作中接触了一些3D打印医疗器械产品。
国家千人计划专家、北京阿迈特医疗器械有限公司董事长刘青则表示,目前,3D打印市场竞争已非常激烈,尤其是在医疗器械领域,不少企业正在加快研发相关产品,以期抢占市场。
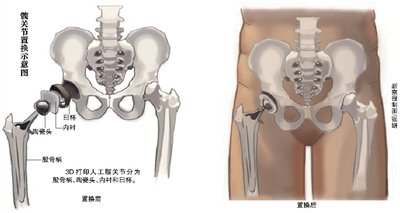
据悉,2015年,北京大学第三医院设计研发的用于髋关节置换的3D打印髋臼杯被原国家食品药品监管总局批准注册上市,迄今已在国内应用上千例。
现状:亟须建适宜的评价技术
3D打印医疗器械技术的快速发展,给患者带来了新的希望。但其产品的安全性与有效性将如何评价?现有的检验方法能否完全检测其安全有效性,保证使用者的安全?
2018年2月1日,中检院在前期科研、检验以及相关标准化工作的基础上,提出申请成为全国医用增材制造技术标准化归口单位,以期对医用增材制造技术开展标准预研,征集标准立项建议,为国家监管部门建立适于3D打印技术监管的相关法规提出建设性意见;评估医用增材制造技术应用的相关风险,为制定特殊风险分析、风险控制等法规性指导原则提供技术支持;建立该技术专业领域的基础通用标准、专用标准、检测与评价方法及其他相关标准。通过标准化工作的推进,加强医用增材制造行业监管,推动产业健康发展。
5月,国家药品监管局同意中检院筹建全国医用增材制造技术标准化归口单位。
“检验技术需要随着新产品和新技术的出现而不断更新,这样才能更准确地进行评价。现在的技术能不能对新产品的安全性和有效性进行评价,这也是大家认为需要研究的问题。所以,我们要在研究的过程中,建立更适宜的检测方法。”韩倩倩认为。
“不但要建立更适宜的检测方法,还要对3D打印的产品进行全链条控制并建立相关标准。”杨昭鹏也认为,现在的检测方法多针对成品进行物理、化学、生物相容性等性能评价,但对于3D打印的产品来说,从原料、软件设计、建模,到从医院、工厂的医工交互以及初产品的粉末残留处理等,整个环节都关系到最终产品的安全性与有效性。“尤其是定制化产品,每一步都要做到一百分,才能保证产品适用于患者。”
“在检验过程中,我们深深体会到标准化工作对于检验的重要性。在检测过程中,我们与企业加强沟通,研究产品的特性,与企业共同研究确认相关标准及检测方法的适用性。在此基础上逐渐形成更加适宜的评价体系,制定相关标准,规范和促进增材制造医疗器械产业的发展。”韩倩倩说。
对此,杨昭鹏也表示,评价检验方法系统是否完善,对保证产品的安全性与有效性至关重要。当评价方法系统成熟后,才能向标准化迈进,以便企业掌握后用于自检。
起步:两项行业标准草案初成
中检院对3D打印这项新技术非常重视,在其设置的学科带头人基金中,2015年就有1项“三维打印血管支架的质量控制和血管内皮化研究”课题。随后,中检院迅速开展了以北京阿迈特医疗器械有限公司研发的3D打印血管支架产品为对象的研究。
“在产品研发阶段,医疗器械检验所就已经介入,这让我们少走很多弯路,沟通起来也很顺畅。现在,产品即将进入临床阶段,阿迈特会继续与医疗器械检验所合作,研究增材制造血管支架用聚乳酸原材料标准。”刘青表示,2016年,他们顺利拿到产品注册检验报告。
韩倩倩表示,在对该产品评价的过程中,医疗器械检验所对相关标准化评价方法开展了深入研究,建立了可降解血管支架材料内皮化评价模型,并申请了专利,还通过研究建立了可降解血管支架材料体内降解和体外降解相关性的公式。面对创新型产品,检验人员要有研究和创新的主观能动性,才能让科研和检验齐头并进。
据悉,目前中检院初步建立了医用增材制造技术标准体系框架。由于现阶段缺乏相关评价技术,中检院承担了“十三五”科技部重点研发计划课题“3D打印医疗器械检验和评价技术研究”。基于前期的标准化研究,中检院已形成了两项行业标准草案,分别为《用于增材制造的医用Ti-6Al4V粉末》(3D打印医疗器械用粉末的要求)和《3D打印钛合金植入物金属离子析出评价方法》,两项标准将于2018年底完成报批。
杨昭鹏表示,欧盟和美国都在积极设立专项研究计划推动3D技术的应用和相关标准法规的建设,我国也已开始探索。中检院会根据医疗器械监管需求和行业质控需求,开展相关研究工作,希望通过标准化工作的推进,切实加强医用增材制造行业的监管,推动产业健康发展。(记者 蒋红瑜)









 大家都在看
大家都在看





 3D打印直通车
3D打印直通车 上传STL文件
上传STL文件 挑选模型
挑选模型