为了使我们的身体正常工作,肾脏在保持血液成分稳定方面起着至关重要的作用。为了实现这一目标,肾脏的大约一百万个过滤单元(肾小球)首先去除多余的水和废物,然后称为近端小管的特殊结构重新吸收将其返回血流的“好”分子。尽管近端小管的重吸收功能可能受到药物,化学物质或遗传和血液传播疾病的影响,但我们对这些影响如何发生的理解仍然有限。
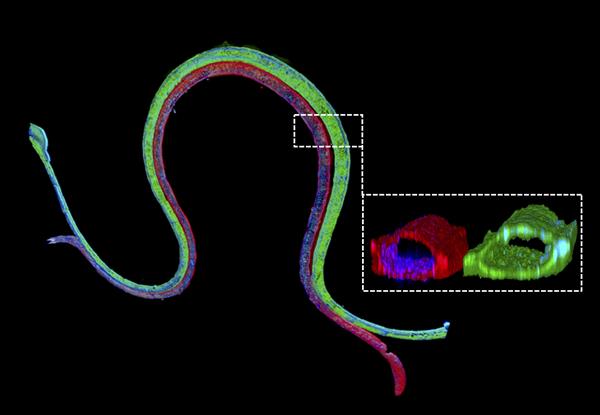
3D生物打印的血管化近端小管的免疫荧光染色,其中近端小管上皮标记物在近端小管通道中以绿色染色,并且血管内皮标记物在相邻血管通道中以红色染色。放大的横截面图示了两种不同的细胞类型在它们各自的通道中形成管腔可灌注结构。
为了研究人体外肾脏重吸收,Wyss Institute核心学院成员Jennifer Lewis,Sc.D与瑞士罗氏罗氏创新中心合作创建了一个3D生物打印血管化近端小管模型,其中可独立灌注的小管和血管在工程细胞外基质内彼此相邻打印。这项工作建立在团队早期报告的持续灌注的3D近端小管模型的基础上,该模型仍缺乏功能性血管隔室。该团队使用他们的下一代设备测量了葡萄糖从近端小管到血管的转运,以及高血糖的影响,这是一种与患者糖尿病相关的疾病。
“我们在几天内构建这些活体肾脏装置,它们可以保持稳定和功能数月,”Neil Lin博士说,他是罗氏研究员和刘易斯团队的博士后研究员。 “重要的是,这些3D血管化的近端小管表现出所需的上皮细胞和内皮细胞形态和管腔结构,以及关键结构和转运蛋白的表达和正确定位,以及允许管状和血管隔室相互通信的因子。 “
作为测试药物和模拟疾病的第一步,该团队通过循环高于正常葡萄糖浓度的4倍,在他们的模型中诱导了“高血糖症”,一种典型的糖尿病高血糖症状和血管疾病的已知危险因素。近端小管隔室。 “我们发现高水平的葡萄糖转运到血管腔内的内皮细胞会导致细胞损伤,”Wyss Institute和SEAS Lewis集团研究员Kimberly Homan博士说。 “通过使药物循环通过特异性抑制近端小管上皮细胞中主要葡萄糖转运蛋白的小管,我们可以防止相邻血管内皮细胞发生这些有害变化。”
该团队的当务之急是进一步扩大这些3D打印模型,以用于制药应用。 “我们的系统可以筛选聚焦药物库的肾毒性,从而有助于减少动物实验,”该研究的行业合作者,罗氏创新中心巴塞尔的首席科学家Annie Moisan博士说。
“我们新的3D打印肾脏模型是一个令人兴奋的进步,因为它更完整地概括了天然肾组织中发现的近端小管段,”刘易斯说。 “除了药物筛选和疾病模型的直接应用之外,我们还在探索这些生命装置是否可以用于增加肾透析。”目前,救生透析机可以过滤血液,但它们无法从身体所需的许多功能中去除滤液中的宝贵营养物和其他物种,这可能导致特定的缺陷和并发症。刘易斯和她的同事认为,3D生物打印的血管化小管可能会改善肾脏替代治疗。
他们的研究发表在美国国家科学院院刊(PNAS)上。







 大家都在看
大家都在看





 3D打印直通车
3D打印直通车 上传STL文件
上传STL文件 挑选模型
挑选模型